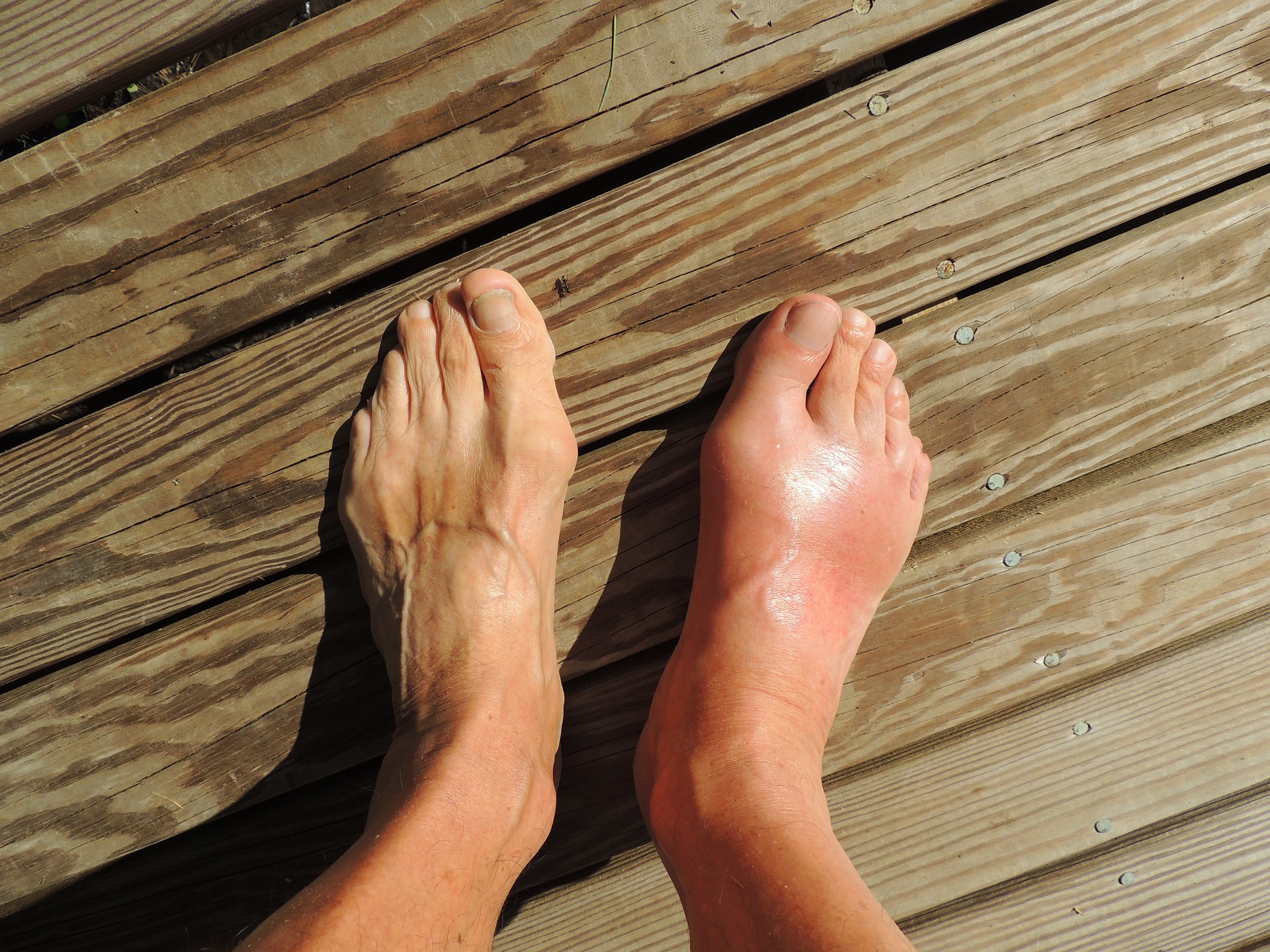
Gota e ácido úrico tratamento atual
A gota é uma artropatia inflamatória causada pela deposição de cristais de ácido úrico, na forma de urato monossódico, nas articulações ou nos tecidos periarticulares.1-4 Raramente, pode ser causada por alterações genéticas.3,5 O ácido úrico é o produto final do metabolismo da purina em humanos.3,6 A hiperuricemia é consequência da sobreprodução de ácido úrico ou de uma diminuição da sua eliminação renal, principal responsável pela excreção.8 O aumento das suas concentrações séricas favorece o aparecimento de gota. Cerca de 10% das pessoas com hiperuricemia desenvolvem gota, mas 80-90% dos doentes com gota são hiperuricémicos.2 Não se recomenda o tratamento de doentes com hiperuricemia assintomáticos.2,3,9,10
Neste artigo suportado pelo trabalho da Dra Aurora Simón, farmacêutica do Centro de Informação do Medicamento (CIM) da Ordem dos Farmacêuticos, são apresentadas as diversas opções farmacológicas atualmente mais utilizadas no tratamento da gota e excesso de ácido úrico.
Sintomas
A crise aguda de gota manifesta-se por dor intensa, inflamação, calor e vermelhidão.3,4,7 A dor aumenta com o contato e a mobilização.11 Na maioria dos casos, a gota manifesta-se de início numa única articulação. Geralmente, a articulação metatarsofalângica do dedo primeiro do pé. À medida que a doença evolui podem ser afetadas múltiplas articulações (por ex., pés, joelhos, cotovelos e mãos).2,3,8,11 A hiperuricemia não tratada pode resultar em gota avançada com tofos (nódulos subcutâneos) e/ ou artrite gotosa crónica.4 Os cristais de ácido úrico também podem ser depositados no trato urinário (urolitíase).3
Diagnóstico
Têm sido propostas diversas escalas diagnósticas que consideram os sinais clínicos presentes.3,11 Para um diagnóstico definitivo, devem ser demonstrados cristais de urato no líquido sinovial ou nos tofos.2,4,8 Níveis normais ou baixos de ácido úrico não excluem o diagnóstico de gota aguda. Um nível elevado aumenta a probabilidade, mas não confirma o diagnóstico.3,4 Algumas modalidades de imagem, como ultrassons e tomografia de dupla energia, podem ser úteis, caso o diagnóstico seja incerto.2,3 A idade avançada e o sexo masculino são fatores de risco.6,8,11
Gota risco cardiovascular e síndrome metabólica
A gota está associada a comorbilidades e a fatores de risco cardiovascular, como hipertensão, diabetes, cardiopatia isquémica, insuficiência cardíaca, obesidade, dislipidemia e síndrome metabólica. É importante que sejam identificados e considerados no tratamento.1,12,13 Na insuficiência renal diminui a excreção de urato, o que também pode resultar em crises de gota.6
O losartan, a atorvastatina, o fenofibrato e os bloqueadores dos canais do cálcio apresentam propriedades fracas de redução de urato.2,4
Causas
O ácido acetilsalicílico em doses baixas e os diuréticos, particularmente as tiazidas e diuréticos da ansa, aumentam a uricemia.2,6-8,10 Alguns fármacos associam-se também a risco de hiperuricemia: citotóxicos, ivabradina, aliscireno, ciclosporina, pirazinamida e etambutol.6-8 Outras causas incluem patologias mieloproliferativas.2 A gota causa incapacidade funcional, absentismo laboral e consequências económicas negativas.4,10 Parece existir um aumento da sua prevalência a nível mundial.2-4,10
Tratamento não farmacológica
Não há evidência suficiente para determinar se as alterações na alimentação e no estilo de vida têm um efeito positivo na evolução da gota. Contudo, os dados sugerem que podem diminuir, em alguma medida, a hiperuricemia8 e contribuir também para a redução das comorbilidades.13 Para muitos autores as recomendações dietéticas devem ser as mesmas que as da prevenção cardiovascular.3 Embora os dados epidemiológicos sugiram que uma alimentação rica em purinas aumenta o risco de gota, há pouca evidência de que os efeitos de uma dieta que as limite sejam clinicamente significativos.10 Aconselha-se moderação na ingestão de precursores de purina ou de proteínas, mas não uma restrição rigorosa.14 Se existirem padrões alimentares e estilos de vida prejudiciais, será especialmente aconselhável:
- Reduzir o peso excessivo,2,5,12-15 e estimular a atividade física regular;12-16
- Incentivar o consumo de vegetais4,9 e produtos lácteos com baixo teor de gordura,12-15 e diminuir as gorduras saturadas.14
- Os alimentos ricos em proteínas, como carnes vermelhas, vísceras ou mariscos devem ser limitados.6,12,14
- Os doentes com gota e litíase renal devem ingerir líquidos suficientes (> 2 L/dia).3
- Reduzir o consumo de álcool,2,5,6,12,13 principalmente cerveja e bebidas espirituosas.12
- Limitar o consumo de bebidas açucaradas.5,12-16 Evitar os refrigerantes e as bebidas com frutose,5,6,14 que inibe a excreção renal de ácido úrico.3
O repouso e elevação da articulação afetada podem contribuir para o tratamento da crise de gota.3,15 A aplicação local de gelo parece diminuir a dor.6,7,15 A educação e o aconselhamento individualizado do doente são importantes.3,12,15,16
Tratamento farmacológico nas crises agudas
Uma crise de gota ocorre geralmente após um período de hiperuricemia assintomático. Se a hiperuricemia persistir, as crises podem ser recorrentes, tornando-se cada vez mais frequentes e prolongadas, afetando muitas articulações.4 Em geral, os sintomas desaparecem entre 3 e 10 dias, mesmo sem tratamento.8,11 Este deve iniciar-se nas primeiras 12 a 24 horas após o início da crise para reduzir a sua gravidade e duração.3,6 Os doentes devem dispor de um plano de ação e de medicamentos para facilitar o tratamento precoce.4,8,12
Durante as crises, o objetivo da terapêutica é melhorar a inflamação e os sintomas.6 Anti- -inflamatórios não esteroides (AINE), colquicina e corticosteroides são opções de primeira linha.2,3,6,9,12 Existem poucos dados comparativos8 e as normas mais recentes não dão prioridade a um medicamento sobre outro.2,9,16 Recomendam ter em consideração as comorbilidades, a medicação concomitante,2,3,9 os tratamentos anteriores, o número de articulações afetadas e as preferências do doente.9,12
Para alguns, os corticosteroides orais devem reservar-se para quem não tolera ou tem contraindicação aos AINE ou à colquicina.5,6,10 Estes podem ser preferidos se há infeção concomitante, intolerância aos corticosteroides, diabetes instável, no pós-operatório e se as crises são frequentes, para limitar as doses totais de corticosteroides.17 Os AINE em doses elevadas, usados a curto prazo, são eficazes.2,8,15 Não foram constatadas diferenças entre eles em termos de eficácia.2,5,6,16 Quando os sintomas diminuem, a dose pode ser reduzida, podendo ser descontinuados 2-3 dias após a sua resolução.17
Os AINE associam-se a disfunção renal,3,7 efeitos adversos cardiovasculares e gastrointestinais.7,8 Pode associar-se um inibidor da bomba de protões, se indicado.12,15 Devem ser evitados em insuficiência renal crónica4,12,15,17,18 ou história de doença gastrointestinal.4,15 Não usar ácido acetilsalicílico ou outros salicilatos, pois diminuem a eliminação renal de ácido úrico.7
Colquicina ou colchicina
Doses orais baixas de colquicina ou colchicina (português do Brasil) têm eficácia semelhante a doses mais elevadas, com um perfil de efeitos adversos mais favorável.2,3,15,16 Há diferentes esquemas terapêuticos, mas pode ser usada uma dose de carga de 1 mg, seguida de 0,5 mg uma hora mais tarde,2,3,4,12,17 continuando o tratamento com 0,5 mg uma ou duas vezes/dia e descontinuando-o 2 ou 3 dias após a resolução.17 É prudente não ultrapassar os 2 mg/dia.1,6
Efeitos secundários graves da Colquicina
Podem surgir efeitos adversos gastrointestinais (diarreia, náuseas, vómitos, dor abdominal), miopatia e distúrbios hematológicos.4,6 Os efeitos são dependentes da dose e podem ser graves.7 As doses deverão ser reduzidas em insuficiência renal ou hepatica,10,15-17 estando desaconselhada nos casos graves. Em doentes tratados com fortes inibidores do CYP3A4 ou da glicoproteína P, como ciclosporina, claritromicina, cimetidina, eritromicina, cetoconazol ou verapamilo, a colquicina tem de ser administrada em doses reduzidas ou evitada.4,12,15,17
Corticosteroides
Os corticosteroides reduzem a dor de forma similar aos AINE.4,16 Pode ser utilizada prednisolona por via oral na dose inicial de 30-40 mg/dia,6,8,13,16 até inicio da resolução, seguida de redução da dose, usualmente, durante 7 a 10 dias.17 Tratamentos curtos de 3-5 dias podem ser efetivos.12,17 Durante o tratamento podem surgir alterações do humor, hiperglicemia, aumento da pressão arterial e retenção de líquidos.3,7,17 Usar com especial precaução e vigilância em insuficiência cardíaca, hipertensão mal controlada ou intolerância à glucose.17 Podem ser uma alternativa em doentes com insuficiência renal.6,17,18 As injeções intra-articulares de corticosteroides podem ser eficazes em monoartrite,4,6,10 mas não têm sido totalmente avaliadas.5,7 Em caso de envolvimento poliarticular podem ser usados por via intravenosa.17
Associações de fármacos
As associações estão indicadas quando as crises são graves, difíceis de tratar ou de maior duração.8 Pode ser experimentada a colquicina com um AINE ou um corticosteroide.9,12
Canacinumab e antagonistas da interleuquina-1
Os antagonistas da Interleucina-1, um importante mediador da inflamação na gota aguda, podem ser uma alternativa para a gota com crises frequentes, se as opções anteriores não se encontrarem disponíveis, sejam ineficazes, contraindicadas ou não toleradas.3,4,9,12,13 O canacinumab, um anticorpo monoclonal inibidor da interleucina-1 beta,4,9 é usado por via subcutânea (150 mg), repetido em intervalo não inferior a 12 semanas.3,7 Os efeitos adversos incluem tonturas, infeções graves3,4 e reações no local da injeção. Está contraindicado na presença de infeções ativas.3,12 Anacinra, não aprovado para a crise de gota, também tem sido ensaiado.6,9,17
Tratamento da hiperuricemia
Após tratamento da crise, a terapêutica de redução de acido úrico (TRAU) deve ser considerada nos doentes com tofos, crises recorrentes (≥2/ano), urolitíase,3,6,9,12 doença renal crónica (estádio ≥2),1,2,6 ou artropatia,1,12 mas também em casos de sobreprodução de acido úrico, por ex., por quimioterapia.3 Recomenda-se o início mais precoce em indivíduos jovens, com hiperuricemia muito elevada e nos que apresentam comorbilidades.12
Os objetivos do tratamento da hiperuricemia a longo prazo são a prevenção da recorrência das crises, a regressão dos tofos e a melhoria da qualidade de vida do doente.6 Normas internacionais recomendam que os níveis séricos de ácido úrico (NSU) sejam mantidos abaixo de 6,8 mg/dL4 (limite de solubilidade, a partir do qual se podem formar cristais de urato).1-3 Na prática, o objetivo da TRAU mais amplamente recomendado é a manutenção de NSU <6 mg/dL (<0,36 mmol/L). Em gota grave com presença de tofos deve ser <5 mg/ dL (<0,30 mmol/L),1-4,10,12 na medida em que níveis menores parecem acelerar a sua resolução.1 Não são recomendados NSU <3 mg/ dL a longo prazo.12
A TRAU será iniciada com uma dose baixa e irá aumentando gradualmente, com monitorização regular (por exemplo, mensal), até ser atingido o NSU alvo. A monitorização deverá continuar durante 6-12 meses.4,10,12
Historicamente, tem sido defendido que a TRAU não deve ser iniciada até à resolução da crise de gota,1,3,5,8 aguardando pelo menos duas semanas.1,4,9 A base desta abordagem é o fato de o início da terapêutica poder precipitar uma crise de gota (ao diminuir os NSU são mobilizados os depósitos)4 e piorar ou prolongar o processo inflamatório.1,10 No entanto, estas complicações não foram totalmente estabelecidas.1,4,9,10 Dois pequenos estudos não encontraram efeitos adversos como resultado do início precoce da TRAU, mas não permitem obter conclusões firmes.12 Alguns especialistas sugeriram que, em determinadas circunstâncias, poderia ser admissível iniciar a TRAU juntamente com anti-inflamatórios durante uma crise,1,4,9,10 individualizando e partilhando a decisão com o doente.9 No futuro, devem ser conduzidos estudos sobre o momento idóneo para início do tratamento.3
Uma TRAU já estabelecida deve continuar durante uma crise aguda.2,3,10,14,15 O tratamento deve ser contínuo e a longo prazo.1,2,12 Os doentes devem conhecer a importância da toma regular e continuada da medicação.15
Tratamento profilático
Devido ao aumento do risco de crises, no início da TRAU devem ser usados concomitantemente fármacos profiláticos no mínimo durante seis meses.2-4,8,10,12 AINE ou colquicina são o tratamento de primeira linha,1-3,10 sendo de segunda a prednisolona.2 Pode ser apropriada a colquicina 0,5-1 mg/ dia.2,4,12,10 A neuromiopatia pode surgir na utilização crónica, especialmente em doentes com insuficiência renal ou que tomam estatinas. Se a colquicina for contraindicada ou não tolerada, pode ser considerado o uso de AINE em doses baixas,1,12,15 (por ex., naproxeno 250 mg duas vezes/dia).4,10 Em doentes com crises frequentes que não toleram a colquicina ou os AINE, podem ser usados glucocorticoides em baixa dose, como prednisona (7,5 mg/dia). Porém, não há estudos sobre esta abordagem.1
Farmacos hipouricemiantes
Atualmente são utilizados os seguintes medicamentos hipouricemiantes:
- Inibidores da xantina oxidase – alopurinol, febuxostate;
- Uricosúricos – probenecid, benzobromarona, lesinurad;
- Uricases – pegloticase, rasburicase.
Inibidores da xantina oxidase
A xantina oxidase catalisa a produção de hipoxantina a partir de xantina e a formação de ácido úrico a partir de hipoxantina.2,9 Os inibidores da xantina oxidase (IXO) reduzem a produção de ácido úrico e do seu precursor.2
Alopurinol
O alopurinol, um análogo da purina que inibe competitivamente a xantina oxidase, é o hipouricemiante de primeira linha.2,4-6,9 Em doentes com função renal normal, a dose inicial é geralmente de 100 mg/dia, aumentando gradualmente, por exemplo cada 2 a 4 semanas, até atingir o objetivo terapêutico.1,2,4,12 A maioria dos doentes requer doses superiores a 300 mg/dia, dose comummente usada. As doses máximas referidas são de 800-900 mg.1,4,10 A adesão à terapêutica a longo prazo é baixa, os doentes devem ser incentivados a continuar a toma.10 Uma dose diária única pode melhorar a adesão.1
Doses superiores a 300 mg podem ser divididas se existe intolerância gastrointestinal.8 Em insuficiência renal, o alopurinol deve ser iniciado com uma dose baixa (por ex., ≤50 mg/dia), aumentado mais lentamente,1,2,9,18 com maior precaução e a intervalos mais longos nos casos de função renal mais reduzida.10 Algumas normas recomendam ajustar a dose máxima de alopurinol à clearance de creatinina (Clcr) em insuficiência renal,12 mas isto conduz frequentemente a sub-tratamento.18
Reações adversas do alopurinol
O alopurinol pode causar reações gastrointestinais e aumento das enzimas hepáticas.1,2,16 Podem surgir vários tipos de erupção cutânea, a maioria leve e que remite com redução ou descontinuação do alopurinol.1 Contudo, mesmo uma erupção leve pode ser precursora de hipersensibilidade, e os doentes devem saber que devem interromper o tratamento e procurar assistência médica imediata se se desenvolver.1,2,9
Síndrome de hipersensibilidade ao alopurinol (SHA)
Um evento muito raro, mas grave, é a síndrome de hipersensibilidade ao alopurinol (SHA), caracterizada por erupções cutâneas (por ex., síndrome de Stevens-Johnson, necrólise epidérmica), eosinofilia, leucocitose, febre, hepatite e insuficiência renal. A mortalidade é relatada em cerca de 25% dos casos.1,2,10 Geralmente ocorre nos primeiros meses de tratamento.2,4 Fatores de risco para seu desenvolvimento são o sexo feminino,2,10 a insuficiência renal, o uso de alguns diuréticos e alguns grupos étnicos, como os portadores do alelo HLA-B * 5801 (mais frequente em indivíduos asiáticos).1,2,10,18 O início com doses baixas reduz o risco de SHA.9 São descritas interações com azatioprina, ampicilina, amoxicilina,1,4 ciclofosfamida,1 teofilina, ciclosporina, diuréticos e inibidores da enzima de conversão da angiotensina.4
Febuxostate
O febuxostate, um IXO com propriedades diferentes do alopurinol,1 é uma alternativa para a hiperuricemia refratária.3,12 É recomendado quando o alopurinol não pode ser utilizado ou quando não são atingidos os objetivos terapêuticos.1,2,12,15 Uma dose de 40 mg/dia de febuxostate tem eficácia similar a 300 mg/dia de alopurinol.2,5 Em ensaios clínicos, na dose de 80-120 mg/dia, o febuxostate mostrou ser mais eficaz na redução da hiperuricemia do que o alopurinol (300 mg/dia),5,9 mas esta dose pode ser considerada subótima.5 Inicialmente, podem ser usados 80 mg/dia, aumentando após 4 semanas para 120 mg/dia, se necessário.4,15
Reações adversos do febuxostate
Há relatos de erupção cutânea e de reações de hipersensibilidade graves, mas são inusuais.1,12,15,16 Também referidos efeitos gastrointestinais e disfunção hepática. É recomendável a monitorização da função hepática.1,3,4
Em alguns estudos, o febuxostate mostrou uma taxa de eventos adversos cardiovasculares mais elevada do que o alopurinol.1,9 Após a comercialização, foi realizado um ensaio de segurança a longo prazo em doentes com gota e doença cardiovascular estabelecida. O febuxostate não aumentou o risco de uma combinação de eventos cardiovasculares relativamente ao alopurinol. Porém, ao analisar os eventos separadamente, o febuxostate apresentou maior risco de morte cardiovascular e morte por todas as causas. Este tema continua em estudo.9,19
Está contraindicado em doença cardíaca isquémica ou doença cardíaca congestiva.1,2,15 A metabolização hepática do febuxostate,2,12 permite o uso em insuficiência renal leve a moderada.1,12,18 O seu uso não foi totalmente avaliado em doentes com Clcr <30 mL/min,2 não estando determinada a dose apropriada.19 Não deve ser usado concomitantemente com azatioprina, mercaptopurina,1,2,4 ou teofilina.1
Fármacos uricosúricos
Os uricosúricos aumentam a eliminação renal de ácido úrico,2,6,9 ao inibirem a sua reabsorção tubular renal.4 São recomendados como tratamento de segunda linha.3,4 O aumento da excreção de ácido úrico no início do tratamento pode promover a formação de cálculos na urina e a crise de gota. Doses iniciais baixas e uma boa hidratação (≥ 2 litros/dia) podem minimizar o risco.
Estão contraindicados em urolitíase. Os uricosúricos podem causar irritação gastrointestinal, reações cutâneas e anorexia. A sua interferência no transporte de aniões orgânicos através das membranas celulares causa múltiplas interações.
Probenecid
Por ex., o probenecid diminui a excreção urinária de penicilina e ampicilina. O probenecid está apenas indicado em doentes com excreção renal de ácido úrico comprometida.1 A eficácia está diminuída em doença renal crónica moderada a grave, não devendo ser usado.6,8,9
Benzobromarona
A benzobromarona é um uricosúrico potente, mas raramente usado pela sua potencial hepatotoxicidade.1,9 Pode ser útil em insuficiência renal ligeira a moderada.1 Probenecid e benzobromarona não estão autorizados em Portugal.
Lesinurad
O lesinurad atua bloqueando os transportadores renais URAT1 e OAT4,3,19 envolvidos na reabsorção renal de ácido úrico.1,19 Em associação com um IXO, alopurinol ou febuxostate, está indicado em doentes que não atingiram os NAU alvo com uma dose adequada de um IXO em monoterapia. O lesinurad não deve ser utilizado sozinho. A dose recomendada é de 200 mg/dia.1,9 Há que garantir uma ingestão adequada de água (2 litros/dia) para diminuir a toxicidade renal.9
Reações adversas
As reações adversas mais frequentes são cefaleias, sintomas de tipo gripal, refluxo gastroesofágico e aumento da creatinina plasmática.1,3,4,9 Pode diminuir o efeito de contracetivos hormonais.4 Pode ser utilizado com precaução em insuficiência renal leve a moderada.6,18 Está contraindicado em insuficiência renal grave, síndrome de lise tumoral e síndrome de Lesch-Nyhan. Devido à insuficiência de dados, não é recomendado em doentes com eventos cardiovasculares nos últimos 12 meses.3 Está autorizado em alguns países europeus. Em 2019, o laboratório parou a sua comercialização nos EUA por motivos comerciais.1,9 Em doentes que não conseguem atingir os objetivos de uricemia pode ser adequada a terapêutica combinada, associando um IXO e um uricosúrico.1,4,12,15
Uricases
A uricase (urato oxidase) converte o ácido úrico em alantoína, mais solúvel em água e prontamente excretada.1,2,4 Está presente na maioria de mamíferos, mas não em humanos.1 Têm sido desenvolvidas uricases recombinantes.9,17
Pegloticase
A pegloticase, usada em gota grave e sintomática, ou quando outras terapias são contraindicadas ou ineficazes,1,4,6,12 foi retirada do mercado europeu em 2016.1,4,6
Rasburicase
A rasburicase está aprovada para a prevenção de nefropatia aguda por ácido úrico devida à síndrome de lise tumoral em doentes com linfoma e leucemia. Não está autorizada no tratamento da gota, a experiência neste uso é limitada.1 As reações alérgicas e a formação de anticorpos são potenciais complicações.2,3,18
Referências bibliográficas
1. Becker MA, Perez-Ruiz F. Pharmacologic urate-lowering therapy and treatment of tophi in patients with gout. UpToDate. Last updated, Jun 18, 2019. Disponível em: www.uptodate.com
2. The management of gout. Aust Prescr. 2016; 39(4): 119–122. doi:10.18773/austprescr.2016.047
3. Engel B, Just J, Bleckwenn M, Weckbecker K. Treatment Options for Gout. Dtsch Arztebl Int. 2017; 114(13): 215–222. doi:10.3238/arztebl.2017.
4. Update on management of gout. National Medicines Information Centre Bulletin. Dt James’s Hospital 2016; 22(6). [acedido a 18-12-19] Disponível em: http://www.stjames.ie/GPsHealthcareProfessionals/Newsletters/NMICBulletins/NMICBulletins2016/#d.en.59280
5. Araújo F, Cordeiro I, Teixeira F, et al. Portuguese recommendations for the diagnosis and management of gout. Acta Reumatol Port. 2014 [acedido a 18-12-19]; 39(2): 158–171. Disponível em: http://www.actareumatologica.pt/archive_detail.php?id=194
6. Fenando A, Widrich J. Gout (Podagra) [Updated 2019 Nov 18]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2019 Jan-. [acedido a 18-12-19] Disponível em: https://www.ncbi.nlm.nih.gov/books/ NBK546606/
7. Crise de goutte. Rev Prescrire. 2017; 37(404): 442-445.
8. Doghramji PP. Atualização no diagnostico e tratamento da gota. Postgrad Med (Ed Port). 2016; 45(6): 44-5.
9. Hiperuricemia y gota. Actualización farmacológica. INFAC. 2019 [acedido a 18-12-19]; 27(4): 25-31. Disponível em: https://www.euskadi.eus/contenidos/informacion/cevime_infac_2019/es_def/adjuntos/INFAC_ Vol_27_4_Hiperuricemia%20y%20Gota.pdf
10. Robinson PC, Stamp LK. The management of gout: Much has changed. Aust Fam Physician. 2016 [acedido a 18-12-19]; 45(5): 299-302. Disponível em: https://www.racgp.org.au/afp/2016/may/the-management-ofgout-much-has-changed/
11. Crise de goutte. Rev Prescrire 2018; 38(417): 532-4.
12.. Richette P, Doherty M, Pascual E, et al. 2016 updated EULAR evidence-based recommendations for the management of gout. Ann Rheum Dis. 2017; 76(1): 29–42. doi:10.1136/annrheumdis-2016-209707.
13. Alvarez-lario B, Alonso-Valdivielso JL. Hiperuricemia y gota: el papel de la dieta. Nutr. Hosp. 2014; 29 (4): 760-770. doi.org/10.3305/nh.2014.29.4.7196.
14. Becker MA. Neogi T. Lifestyle modification and other strategies to reduce the risk of gout flares and progression of gout. UpToDate. Last updated, Dec 01, 2019. Disponível em: www.uptodate.com
15. Hui M, Carr A, Cameron S, et al. The British Society for Rheumatology Guideline for the Management of Gout [published correction appears in Rheumatology (Oxford). 2017 Jul 1; 56(7): 1246]. Rheumatology (Oxford). 2017; 56(7): 1056–1059. doi:10.1093/rheumatology/kex150
16. Noss MR, Saguil A. Gout: Diagnosis and Management. Am Fam Physician. 2017 [acedido a 18-12-19]; 96(10): 668–670. Disponível em: https://www.aafp.org/afp/2017/1115/p668.pdf
17. Treatment of gout flares. UpToDate. Last updated, Dec 04, 2019. Disponível em: http://www.uptodate.com/
18. Adis Medical Writers. Be cautious when treating gout in patients with renal impairment. Drugs Ther Perspect. 2019; 35: 24-28.
19. Punzi L, Scanu A, Spinella P, Galozzi P, Oliviero F. One year in review 2018: gout. Clin Exp Rheumatol. 2019 [acedido a 18-12-19]; 37(1): 1–11. Disponível em: https://www.clinexprheumatol.org/article.asp?a=13479